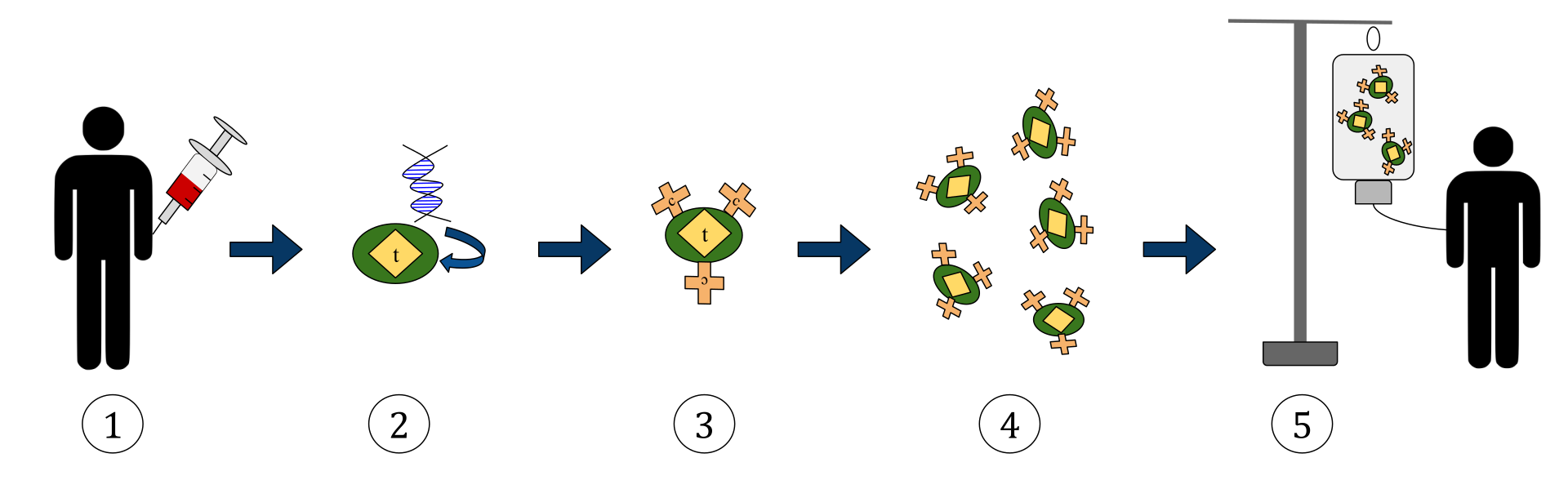
แผนภาพด้านบนแสดงถึงกระบวนการของการบำบัดด้วย T-cell receptor chimeric antigen receptor (CAR) นี่เป็นวิธีการบำบัดด้วยภูมิคุ้มกันซึ่งเป็นแนวทางปฏิบัติที่เพิ่มมากขึ้นในการรักษาโรคมะเร็ง ผลลัพธ์สุดท้ายควรเป็นการผลิต T-cells ที่มีอุปกรณ์ซึ่งสามารถจดจำและต่อสู้กับเซลล์มะเร็งที่ติดเชื้อในร่างกายได้
1. T-cells (แสดงโดยวัตถุที่ระบุว่า ‘t’) จะถูกลบออกจากเลือดของผู้ป่วย
2. จากนั้นในห้องปฏิบัติการกำหนดยีนที่เข้ารหัสสำหรับตัวรับแอนติเจนที่เฉพาะเจาะจงจะรวมอยู่ใน T-cells
3. ดังนั้นการผลิตตัวรับ CAR (ระบุว่า c) บนพื้นผิวของเซลล์
4. จากนั้น T-cells ที่ปรับเปลี่ยนใหม่จะถูกเก็บเกี่ยวและปลูกในห้องแล็บต่อไป
5. หลังจากช่วงเวลาหนึ่ง T-cells ที่ออกแบบมาจะถูกส่งกลับไปยังผู้ป่วย
เซลล์ T ตัวรับแอนติเจนของ Chimeric (หรือที่เรียกว่า CAR T เซลล์) เป็นเซลล์ T ที่ได้รับการดัดแปลงพันธุกรรมเพื่อผลิตตัวรับ T-cell เทียมเพื่อใช้ในการบำบัดด้วยภูมิคุ้มกัน
ตัวรับแอนติเจน Chimeric (รถหรือที่เรียกว่า chimeric immunoreceptors, ตัวรับเซลล์ T chimeric, หรือ ตัวรับ T เซลล์เทียม) เป็นโปรตีนตัวรับที่ได้รับการออกแบบมาเพื่อให้เซลล์ T มีความสามารถใหม่ในการกำหนดเป้าหมายโปรตีนที่เฉพาะเจาะจง ตัวรับมีความแปลกประหลาดเนื่องจากรวมทั้งฟังก์ชันการทำงานของแอนติเจนที่มีผลผูกพันและ T-cell ไว้ในตัวรับเดียว
การบำบัดด้วยเซลล์ CAR-T ใช้เซลล์ T ที่ออกแบบด้วย CAR สำหรับการบำบัดโรคมะเร็ง สมมติฐานของการบำบัดด้วยภูมิคุ้มกัน CAR-T คือการปรับเปลี่ยนเซลล์ T ให้รู้จักเซลล์มะเร็งเพื่อกำหนดเป้าหมายและทำลายเซลล์เหล่านี้ได้อย่างมีประสิทธิภาพมากขึ้น นักวิทยาศาสตร์เก็บเกี่ยวเซลล์ T จากคนดัดแปลงพันธุกรรมจากนั้นใส่เซลล์ CAR-T ที่เป็นผลลัพธ์เข้าไปในผู้ป่วยเพื่อโจมตีเนื้องอก เซลล์ CAR-T สามารถได้มาจากเซลล์ T ในเลือดของผู้ป่วยเอง (autologous) หรือได้มาจากเซลล์ T ของผู้บริจาคที่มีสุขภาพดีรายอื่น (allogeneic) เมื่อแยกออกจากบุคคลแล้วเซลล์ T เหล่านี้จะได้รับการปรับแต่งทางพันธุกรรมเพื่อแสดง CAR ที่เฉพาะเจาะจงซึ่งตั้งโปรแกรมให้กำหนดเป้าหมายแอนติเจนที่มีอยู่บนพื้นผิวของเนื้องอก เพื่อความปลอดภัยเซลล์ CAR-T ได้รับการออกแบบมาเพื่อให้เฉพาะกับแอนติเจนที่แสดงออกบนเนื้องอกที่ไม่ได้แสดงออกในเซลล์ที่มีสุขภาพดี
หลังจากที่เซลล์ CAR-T เข้าไปในผู้ป่วยแล้วเซลล์เหล่านี้จะทำหน้าที่เป็น “ยาที่มีชีวิต” เพื่อต่อต้านเซลล์มะเร็ง เมื่อพวกเขาสัมผัสกับแอนติเจนเป้าหมายของพวกเขาในเซลล์เซลล์ CAR-T จะจับกับมันและเปิดใช้งานจากนั้นดำเนินการแพร่กระจายและกลายเป็นพิษต่อเซลล์ เซลล์ CAR-T ทำลายเซลล์ด้วยกลไกต่างๆรวมถึงการเพิ่มจำนวนเซลล์ที่ถูกกระตุ้นอย่างกว้างขวางการเพิ่มระดับที่เป็นพิษต่อเซลล์ของสิ่งมีชีวิตอื่น ๆ (ความเป็นพิษต่อเซลล์) และทำให้เกิดการหลั่งที่เพิ่มขึ้นของปัจจัยที่อาจส่งผลต่อเซลล์อื่น ๆ เช่นไซโตไคน์อินเตอร์ลิวคินส์และ ปัจจัยการเติบโต
การผลิตเซลล์ CAR-T

ขั้นตอนแรกในการผลิตเซลล์ CAR-T คือการแยกเซลล์ T ออกจากเลือดของมนุษย์ เซลล์ CAR-T อาจผลิตขึ้นจากเลือดของผู้ป่วยเองหรือที่เรียกว่าการรักษาโดยอัตโนมัติหรือจากเลือดของผู้บริจาคที่มีสุขภาพดีซึ่งเรียกว่าการรักษาแบบ allogeneic กระบวนการผลิตจะเหมือนกันในทั้งสองกรณี ทางเลือกของผู้บริจาคโลหิตเริ่มต้นเท่านั้นที่แตกต่างกัน
ประการแรกเม็ดเลือดขาวจะถูกแยกโดยใช้เครื่องแยกเซลล์เม็ดเลือดในกระบวนการที่เรียกว่า leukocyte apheresis จากนั้นเซลล์โมโนนิวเคลียร์ในเลือดส่วนปลาย (PBMC) จะถูกแยกและรวบรวม จากนั้นผลิตภัณฑ์ของ leukocyte apheresis จะถูกถ่ายโอนไปยังศูนย์ประมวลผลเซลล์ ในศูนย์ประมวลผลเซลล์เซลล์ T ที่เฉพาะเจาะจงจะได้รับการกระตุ้นเพื่อให้พวกมันแพร่กระจายอย่างแข็งขันและขยายเป็นจำนวนมาก เพื่อผลักดันการขยายตัวโดยทั่วไปเซลล์ T จะได้รับการรักษาด้วยไซโตไคน์อินเตอร์ลิวคิน 2 (IL-2) และแอนติบอดีต่อต้าน CD3
เซลล์ T ที่ขยายตัวจะถูกทำให้บริสุทธิ์แล้วถ่ายทอดด้วยยีนที่เข้ารหัส CAR ที่ได้รับการออกแบบทางวิศวกรรมผ่านเวกเตอร์ retroviral ซึ่งโดยทั่วไปแล้วจะเป็นเวกเตอร์ gammaretrovirus (RV) หรือ lentiviral (LV) เวกเตอร์เหล่านี้ปลอดภัยมากในยุคปัจจุบันเนื่องจากการลบพื้นที่ U3 บางส่วน เครื่องมือแก้ไขยีนใหม่ CRISPR / Cas9 เพิ่งถูกนำมาใช้แทนเวกเตอร์เรโทรไวรัสเพื่อรวมยีน CAR เข้ากับไซต์เฉพาะในจีโนม
ผู้ป่วยได้รับเคมีบำบัดต่อมน้ำเหลืองก่อนที่จะนำเซลล์ CAR-T ที่ออกแบบมา การลดจำนวนเม็ดเลือดขาวที่หมุนเวียนในผู้ป่วยจะทำให้จำนวนของไซโตไคน์ที่ผลิตขึ้นและลดการแย่งชิงทรัพยากรซึ่งจะช่วยส่งเสริมการขยายตัวของเซลล์ CAR-T ที่ได้รับการออกแบบทางวิศวกรรม
การใช้งานทางคลินิก
ในเดือนมีนาคม 2019 มีการทดลองทางคลินิกอย่างต่อเนื่องประมาณ 364 ครั้งที่เกิดขึ้นทั่วโลกที่เกี่ยวข้องกับเซลล์ CAR-T การทดลองเหล่านี้ส่วนใหญ่มุ่งเป้าไปที่โรคมะเร็งในเลือด: การรักษาด้วย CAR-T คิดเป็นมากกว่าครึ่งหนึ่งของการทดลองทั้งหมดสำหรับโรคมะเร็งทางโลหิตวิทยา CD19 ยังคงเป็นเป้าหมายแอนติเจนที่ได้รับความนิยมมากที่สุดตามด้วย BCMA (โดยทั่วไปจะแสดงใน multiple myeloma) ในปี 2559 การศึกษาเริ่มสำรวจความมีชีวิตของแอนติเจนอื่น ๆ เช่น CD20 การทดลองเนื้องอกที่เป็นของแข็งนั้นถูกครอบงำโดย CAR-T น้อยกว่าโดยประมาณครึ่งหนึ่งของการทดลองที่ใช้เซลล์บำบัดที่เกี่ยวข้องกับแพลตฟอร์มอื่น ๆ เช่นเซลล์ NK
โรคมะเร็ง
เซลล์ T ได้รับการปรับแต่งทางพันธุกรรมเพื่อแสดงตัวรับแอนติเจนของ chimeric ที่มุ่งตรงไปยังแอนติเจนในเซลล์เนื้องอกของผู้ป่วยจากนั้นจะผสมเข้าไปในผู้ป่วยที่พวกมันโจมตีและฆ่าเซลล์มะเร็งการถ่ายโอนเซลล์ T ที่แสดงออกโดยใช้ CARs เป็นวิธีการรักษาที่มีแนวโน้มต่อต้านมะเร็งเนื่องจาก เซลล์ T ที่ดัดแปลงด้วย CAR สามารถออกแบบมาเพื่อกำหนดเป้าหมายไปยังแอนติเจนที่เกี่ยวข้องกับเนื้องอกได้
การวิจัยเซลล์ CAR-T ในช่วงต้นได้มุ่งเน้นไปที่มะเร็งในเลือด การรักษาที่ได้รับการอนุมัติครั้งแรกใช้ CAR ที่กำหนดเป้าหมายไปที่แอนติเจน CD19 ซึ่งมีอยู่ในมะเร็งที่ได้จากเซลล์ B เช่นมะเร็งเม็ดเลือดขาวชนิดเม็ดเลือดขาวเฉียบพลัน (ALL) และมะเร็งต่อมน้ำเหลือง B-cell ขนาดใหญ่แบบกระจาย (DLBCL) นอกจากนี้ยังมีความพยายามในการออกแบบ CAR ที่กำหนดเป้าหมายไปยังแอนติเจนมะเร็งในเลือดอื่น ๆ อีกมากมายรวมถึง CD30 ในมะเร็งต่อมน้ำเหลือง Hodgkin ที่ทนไฟ CD33, CD123 และ FLT3 ในมะเร็งเม็ดเลือดขาวชนิดไมอิลอยด์เฉียบพลัน (AML); และ BCMA ใน multiple myeloma
เนื้องอกที่เป็นของแข็งได้นำเสนอเป้าหมายที่ยากขึ้น การระบุแอนติเจนที่ดีเป็นสิ่งที่ท้าทาย: แอนติเจนดังกล่าวต้องแสดงออกอย่างมากในเซลล์มะเร็งส่วนใหญ่ แต่ส่วนใหญ่จะไม่มีอยู่ในเนื้อเยื่อปกติ นอกจากนี้เซลล์ CAR-T จะไม่ถูกค้าอย่างมีประสิทธิภาพไปยังศูนย์กลางของก้อนเนื้องอกที่เป็นของแข็งและสภาพแวดล้อมขนาดเล็กของเนื้องอกที่ไม่เป็นมิตรจะยับยั้งการทำงานของเซลล์ T
โรคแพ้ภูมิตัวเอง
ในขณะที่การศึกษา CAR T-cell ส่วนใหญ่มุ่งเน้นไปที่การสร้าง CAR T-cell ที่สามารถกำจัดประชากรเซลล์บางส่วนได้ (ตัวอย่างเช่น CAR T-cells ที่กำหนดเป้าหมายไปยังเซลล์มะเร็งต่อมน้ำเหลือง) แต่ก็มีศักยภาพในการใช้เทคโนโลยีนี้อื่น ๆ T-cells ยังสามารถป้องกันแอนติเจนในตัวเองจากปฏิกิริยาแพ้ภูมิตัวเอง T-cell ตามกฎข้อบังคับที่ติดตั้ง CAR อาจมีศักยภาพในการให้ความทนทานต่อแอนติเจนที่เฉพาะเจาะจงซึ่งสามารถใช้ในการปลูกถ่ายอวัยวะหรือโรคไขข้อเช่นโรคลูปัส
Satefy
มีผลข้างเคียงที่ร้ายแรงซึ่งเป็นผลมาจากการที่เซลล์ CAR-T ถูกนำเข้าสู่ร่างกายรวมถึงกลุ่มอาการของการปลดปล่อยไซโตไคน์และความเป็นพิษต่อระบบประสาท เนื่องจากเป็นการรักษาที่ค่อนข้างใหม่จึงมีข้อมูลเพียงเล็กน้อยเกี่ยวกับผลระยะยาวของการบำบัดด้วยเซลล์ CAR-T ยังคงมีความกังวลเกี่ยวกับการรอดชีวิตของผู้ป่วยในระยะยาวตลอดจนภาวะแทรกซ้อนจากการตั้งครรภ์ในผู้ป่วยหญิงที่ได้รับการรักษาด้วยเซลล์ CAR-T Anaphylaxis เป็นผลข้างเคียงที่คาดไว้เนื่องจาก CAR ทำด้วยโมโนโคลนอลแอนติบอดีจากต่างประเทศและส่งผลให้เกิดการตอบสนองของระบบภูมิคุ้มกัน
การรับรู้ตามเป้าหมาย / นอกเนื้องอกเกิดขึ้นเมื่อเซลล์ CAR-T รับรู้แอนติเจนที่ถูกต้อง แต่แอนติเจนจะแสดงออกบนเนื้อเยื่อที่มีสุขภาพดีและไม่ก่อโรค ส่งผลให้เซลล์ CAR-T โจมตีเนื้อเยื่อที่ไม่ใช่เนื้องอกเช่นเซลล์ B ที่มีสุขภาพดีซึ่งแสดง CD19 ความรุนแรงของผลข้างเคียงนี้อาจแตกต่างกันไปจาก B-cell aplasia ซึ่งสามารถรักษาได้ด้วยการให้ยาสนับสนุนไปจนถึงความเป็นพิษขั้นรุนแรงที่นำไปสู่การเสียชีวิต
นอกจากนี้ยังมีความเป็นไปได้ที่ไม่น่าจะเป็นไปได้ที่เซลล์ CAR-T ที่ได้รับการออกแบบทางวิศวกรรมจะเปลี่ยนเป็นเซลล์มะเร็งผ่านการกลายพันธุ์แบบแทรกเนื่องจากเวกเตอร์ของไวรัสที่ใส่ยีน CAR เข้าไปในตัวยับยั้งเนื้องอกหรือมะเร็งในจีโนมของเซลล์ T ของโฮสต์ เวกเตอร์ retroviral (RV) บางตัวมีความเสี่ยงต่ำกว่าเวกเตอร์ lentiviral (LV) อย่างไรก็ตามทั้งสองมีศักยภาพที่จะก่อมะเร็งได้ การวิเคราะห์ลำดับจีโนมของไซต์แทรก CAR ใน T เซลล์ได้รับการจัดตั้งขึ้นเพื่อให้เข้าใจการทำงานของเซลล์ CAR T และความคงอยู่ในร่างกายได้ดีขึ้น
Cytokine release syndrome
ปัญหาที่พบบ่อยที่สุดหลังการรักษาด้วยเซลล์ CAR-T คือไซโตไคน์รีลีสซินโดรม (CRS) ซึ่งเป็นภาวะที่ระบบภูมิคุ้มกันทำงานและปล่อยไซโตไคน์อักเสบเพิ่มจำนวนมากขึ้น อาการทางคลินิกของกลุ่มอาการนี้คล้ายกับภาวะติดเชื้อที่มีไข้สูงอ่อนเพลียปวดกล้ามเนื้อคลื่นไส้เส้นเลือดฝอยรั่วหัวใจเต้นเร็วและหัวใจทำงานผิดปกติอื่น ๆ ตับวายและไตเสื่อม CRS เกิดขึ้นในผู้ป่วยเกือบทั้งหมดที่ได้รับการรักษาด้วยเซลล์ CAR-T ในความเป็นจริงการปรากฏตัวของ CRS เป็นเครื่องหมายการวินิจฉัยที่บ่งชี้ว่าเซลล์ CAR-T กำลังทำงานตามที่ตั้งใจจะฆ่าเซลล์มะเร็ง อย่างไรก็ตามโปรดทราบว่าความรุนแรงของ CRS ในระดับที่สูงขึ้นไม่ได้มีความสัมพันธ์กับการตอบสนองที่เพิ่มขึ้นต่อการรักษา แต่เป็นภาระโรคที่สูงกว่า
ความเป็นพิษต่อระบบประสาทที่เกี่ยวข้องกับเซลล์
ความเป็นพิษต่อระบบประสาทมักเกี่ยวข้องกับการรักษาเซลล์ CAR-T กลไกที่เป็นพื้นฐานนั้นเข้าใจได้ไม่ดีและอาจเกี่ยวข้องหรือไม่เกี่ยวข้องกับ CRS อาการทางคลินิก ได้แก่ อาการเพ้อการสูญเสียความสามารถในการพูดบางส่วนอย่างสอดคล้องกันในขณะที่ยังมีความสามารถในการตีความภาษา (ความพิการทางสมองที่แสดงออก) ความตื่นตัวที่ลดลง (การมีน้ำท่วม) และอาการชัก ในระหว่างการทดลองทางคลินิกบางอย่างมีการเสียชีวิตที่เกิดจากพิษต่อระบบประสาท สาเหตุหลักของการเสียชีวิตจากพิษต่อระบบประสาทคือสมองบวม ในการศึกษาของ Juno Therapeutics, Inc. ผู้ป่วย 5 รายที่ลงทะเบียนในการทดลองนี้เสียชีวิตเนื่องจากอาการบวมน้ำในสมอง ผู้ป่วยสองรายได้รับการรักษาด้วย cyclophosphamide เพียงอย่างเดียวและอีกสามรายที่เหลือได้รับการรักษาร่วมกันของ cyclophosphamide และ fludarabine ในการทดลองทางคลินิกอื่นที่ได้รับการสนับสนุนโดยศูนย์วิจัยมะเร็งเฟรดฮัทชินสันมีรายงานกรณีหนึ่งของความเป็นพิษทางระบบประสาทที่ไม่สามารถย้อนกลับได้และถึงแก่ชีวิต 122 วันหลังจากการให้เซลล์ CAR-T
.












Discussion about this post