| อัลฟาอะไมเลส | |||||||||
|---|---|---|---|---|---|---|---|---|---|
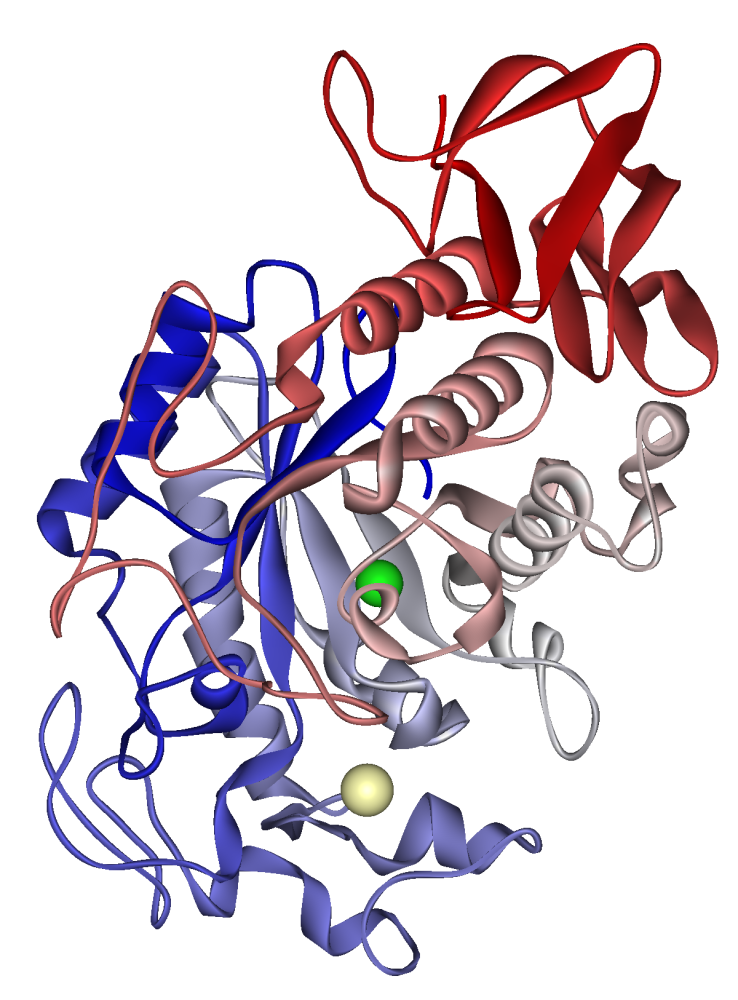
อะไมเลสทำน้ำลายของมนุษย์: แคลเซียมไอออนที่มองเห็นได้ในสีกากีซีดคลอไรด์อิออนเป็นสีเขียว PDB 1SMD
|
|||||||||
| ตัวระบุ | |||||||||
| หมายเลข EC | 3.2.1.0 | ||||||||
| เลขที่ CAS | 9000-90-2 | ||||||||
| ฐานข้อมูล | |||||||||
| IntEnz | มุมมอง IntEnz | ||||||||
| เบรนดา | รายการ BRENDA | ||||||||
| ExPASy | มุมมอง NiceZyme | ||||||||
| KEGG | รายการ KEGG | ||||||||
| MetaCyc | วิถีการเผาผลาญ | ||||||||
| PRIAM | ข้อมูลส่วนตัว | ||||||||
| โครงสร้าง PDB | RCSB PDB PDBe PDBsum | ||||||||
|
|||||||||
| โดเมนตัวเร่งปฏิกิริยา GH13 | |||||||||
|---|---|---|---|---|---|---|---|---|---|

ไซโคลเดกซ์ทรินกลูคาโนทรานสเฟอเรส (ec2.4.1.19) (cgtase)
|
|||||||||
| ตัวระบุ | |||||||||
| สัญลักษณ์ | อัลฟาอะไมเลส | ||||||||
| Pfam | PF00128 | ||||||||
| ตระกูล Pfam | CL0058 | ||||||||
| อินเตอร์โปร | IPR006047 | ||||||||
| ขอบเขต 2 | 1ppi / ขอบเขต / SUPFAM | ||||||||
| OPM Superfamily | 117 | ||||||||
| โปรตีน OPM | 1wza | ||||||||
| CAZy | GH13 | ||||||||
| CDD | cd11338 | ||||||||
|
|||||||||
| Alpha-amylase C-terminal beta-sheet โดเมน | |||||||||
|---|---|---|---|---|---|---|---|---|---|

โครงสร้างผลึกของข้าวบาร์เลย์ alpha-amylase isozyme 1 (amy1) d180a ที่ไม่ใช้งานกลายพันธุ์ในสารประกอบเชิงซ้อนที่มี maltoheptaose
|
|||||||||
| ตัวระบุ | |||||||||
| สัญลักษณ์ | Alpha-amyl_C2 | ||||||||
| Pfam | PF07821 | ||||||||
| อินเตอร์โปร | IPR012850 | ||||||||
|
|||||||||
| อัลฟาอะไมเลสโดเมน C-terminal all-beta | |||||||||
|---|---|---|---|---|---|---|---|---|---|
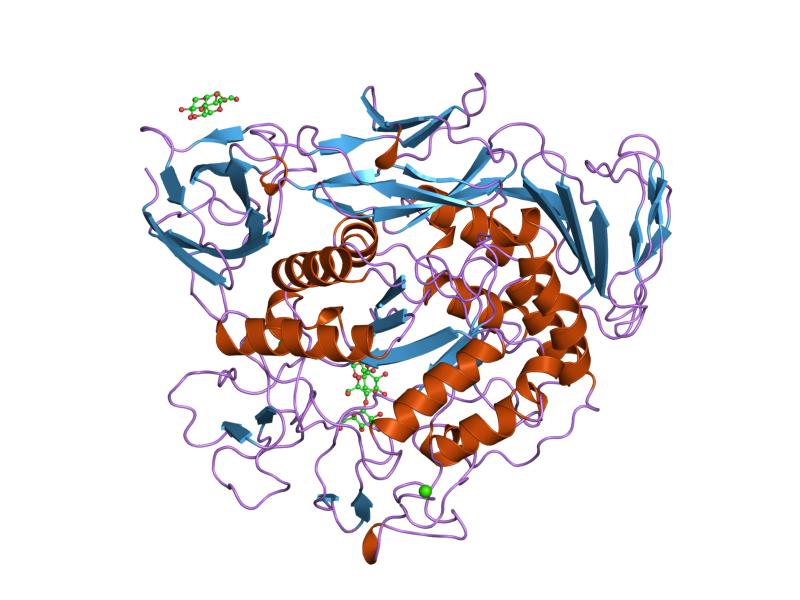
มอลโตทริโอสคอมเพล็กซ์ของไซโคลเดกซ์ทรินไกลโคซิลทรานสเฟอเรสที่กลายพันธุ์
|
|||||||||
| ตัวระบุ | |||||||||
| สัญลักษณ์ | อัลฟาอะไมเลส _ | ||||||||
| Pfam | PF02806 | ||||||||
| ตระกูล Pfam | CL0369 | ||||||||
| อินเตอร์โปร | IPR006048 | ||||||||
| ขอบเขต 2 | 1ppi / ขอบเขต / SUPFAM | ||||||||
|
|||||||||
อัลฟาอะไมเลส, (α-อะไมเลส) เป็นเอนไซม์ EC 3.2.1.1 ที่ไฮโดรไลส์พันธะอัลฟาของโพลีแซ็กคาไรด์ขนาดใหญ่ที่เชื่อมโยงกับอัลฟาเช่นแป้งและไกลโคเจนทำให้เกิดสายโซ่ที่สั้นกว่าเดกซ์ทรินและมอลโตส เป็นรูปแบบหลักของอะไมเลสที่พบในมนุษย์และสัตว์เลี้ยงลูกด้วยนมอื่น ๆ นอกจากนี้ยังมีอยู่ในเมล็ดพืชที่มีแป้งเป็นอาหารสำรองและมีเชื้อราหลายชนิดหลั่งออกมา เป็นสมาชิกของตระกูลไกลโคไซด์ไฮโดรเลส 13.
ในชีววิทยาของมนุษย์
แม้ว่าจะพบในเนื้อเยื่อหลายชนิด แต่อะไมเลสมีความโดดเด่นที่สุดในน้ำตับอ่อนและน้ำลายซึ่งแต่ละชนิดมีไอโซฟอร์มของα-amylase ของมนุษย์ พวกมันทำงานแตกต่างกันในการโฟกัสแบบไอโซอิเล็กทริกและยังสามารถแยกออกได้ในการทดสอบโดยใช้โมโนโคลนอลแอนติบอดีที่เฉพาะเจาะจง ในมนุษย์ไอโซฟอร์มอะไมเลสทั้งหมดเชื่อมโยงกับโครโมโซม 1p21 (ดู AMY1A)
อะไมเลสทำน้ำลาย (ptyalin)
อะไมเลสพบในน้ำลายและแบ่งแป้งเป็นมอลโตสและเดกซ์ทริน อะไมเลสรูปแบบนี้เรียกอีกอย่างว่า “ptyalin” /ˈtกəlɪn/ซึ่งได้รับการตั้งชื่อโดยJöns Jacob Berzelius นักเคมีชาวสวีเดน ชื่อนี้มาจากภาษากรีกคำว่าπτυω (I spit) เนื่องจากสารได้มาจากน้ำลาย มันจะแตกโมเลกุลของแป้งขนาดใหญ่ที่ไม่ละลายน้ำให้กลายเป็นแป้งที่ละลายน้ำได้ (อะไมโลเดกซ์ทริน, erythrodextrin และ achrodextrin) ทำให้ได้แป้งที่มีขนาดเล็กลงอย่างต่อเนื่องและในที่สุดก็เป็นมอลโตส Ptyalin ทำหน้าที่เชื่อมโยง glycosidic α (1,4) เชิงเส้น แต่การไฮโดรไลซิสแบบผสมต้องใช้เอนไซม์ที่ทำหน้าที่ในผลิตภัณฑ์ที่แตกแขนง อะไมเลสทำน้ำลายถูกปิดการใช้งานในกระเพาะอาหารโดยกรดในกระเพาะอาหาร ในน้ำย่อยที่ปรับเป็น pH 3.3 ptyalin จะถูกปิดใช้งานโดยสิ้นเชิงใน 20 นาทีที่อุณหภูมิ 37 ° C ในทางตรงกันข้ามกิจกรรมของอะไมเลส 50% ยังคงอยู่หลังจาก 150 นาทีของการสัมผัสกับน้ำย่อยที่ pH 4.3 ทั้งแป้งสารตั้งต้นสำหรับ ptyalin และผลิตภัณฑ์ (กลุ่มกลูโคสสั้น ๆ ) สามารถป้องกันได้บางส่วนจากการยับยั้งโดยกรดในกระเพาะอาหาร Ptyalin ถูกเพิ่มเข้าไปในบัฟเฟอร์ที่ pH 3.0 ผ่านการปิดการใช้งานอย่างสมบูรณ์ใน 120 นาที อย่างไรก็ตามการเติมแป้งในระดับ 0.1% ส่งผลให้มีกิจกรรมที่เหลืออยู่ 10% และการเติมแป้งที่คล้ายกันเป็นระดับ 1.0% ส่งผลให้มีกิจกรรมประมาณ 40% ที่เหลืออยู่ที่ 120 นาที
เงื่อนไขที่เหมาะสมสำหรับ ptyalin
- pH ที่เหมาะสม – 7.0
- อุณหภูมิร่างกายของมนุษย์
- การปรากฏตัวของแอนไอออนและตัวกระตุ้นบางอย่าง:
- คลอไรด์และโบรไมด์ – มีประสิทธิภาพสูงสุด
- ไอโอไดด์ – มีประสิทธิภาพน้อยกว่า
- ซัลเฟตและฟอสเฟต – มีประสิทธิภาพน้อยที่สุด
การเปลี่ยนแปลงทางพันธุกรรมในอะไมเลสทำน้ำลายของมนุษย์
ยีนอะไมเลสทำน้ำลายได้รับการทำสำเนาระหว่างวิวัฒนาการและการศึกษาการผสมดีเอ็นเอบ่งชี้ว่าบุคคลจำนวนมากมียีนซ้ำหลายครั้ง จำนวนสำเนาของยีนมีความสัมพันธ์กับระดับของอะไมเลสที่ทำน้ำลายซึ่งวัดได้จากการทดสอบก้อนโปรตีนโดยใช้แอนติบอดีต่ออะไมเลสของมนุษย์ หมายเลขสำเนายีนมีความสัมพันธ์กับการได้รับวิวัฒนาการอย่างชัดเจนต่ออาหารที่มีแป้งสูง ตัวอย่างเช่นคนญี่ปุ่นมียีนอะไมเลส 14 สำเนา (อัลลีล 1 ชุดมี 10 ชุดและอัลลีลที่สองมีสำเนา 4 ชุด) อาหารญี่ปุ่นมักมีแป้งข้าวจำนวนมาก ในทางตรงกันข้าม Biaka แต่ละคนมีสำเนาหกชุด (สามชุดสำหรับแต่ละอัลลีล) Biaka เป็นนักล่าสัตว์ป่าดงดิบที่เคยบริโภคอาหารที่มีแป้งต่ำ เพอร์รีและเพื่อนร่วมงานคาดการณ์ว่าจำนวนสำเนาที่เพิ่มขึ้นของยีนอะไมเลสที่ทำน้ำลายอาจช่วยเพิ่มการอยู่รอดได้โดยบังเอิญเมื่อเปลี่ยนไปรับประทานอาหารจำพวกแป้งในช่วงวิวัฒนาการของมนุษย์
อะไมเลสตับอ่อน
ตับอ่อนα-amylase สุ่มแยกการเชื่อมโยงไกลโคซิดิกα (1-4) ของอะไมโลสเพื่อให้ได้เดกซ์ทรินมอลโตสหรือมอลโตทริโอส ใช้กลไกการกระจัดสองครั้งพร้อมการเก็บรักษาการกำหนดค่าที่ผิดปกติ ในมนุษย์อะไมเลสทำน้ำลายวิวัฒนาการมาจากสำเนาของมัน
ในพยาธิวิทยา
การทดสอบอะไมเลสทำได้ง่ายกว่าสำหรับไลเปสทำให้เป็นการทดสอบหลักที่ใช้ในการตรวจหาและตรวจสอบตับอ่อนอักเสบ ห้องปฏิบัติการทางการแพทย์มักจะตรวจวัดอะไมเลสในตับอ่อนหรืออะไมเลสทั้งหมด หากวัดเฉพาะอะไมเลสในตับอ่อนจะไม่พบการเพิ่มขึ้นของคางทูมหรือการบาดเจ็บที่ต่อมน้ำลายอื่น ๆ
อย่างไรก็ตามเนื่องจากมีจำนวนน้อยเวลาจึงมีความสำคัญในการสุ่มตัวอย่างเลือดสำหรับการวัดนี้ ควรถ่ายเลือดทันทีหลังจากมีอาการปวดตับอ่อนอักเสบมิฉะนั้นจะถูกขับออกทางไตอย่างรวดเร็ว
α-amylase ทำน้ำลายถูกใช้เป็นตัวบ่งชี้ทางชีวภาพสำหรับความเครียดและเป็นเครื่องหมายตัวแทนของกิจกรรมระบบประสาทซิมพาเทติก (SNS) ที่ไม่ต้องเจาะเลือด
การตีความ
ระดับพลาสมาที่เพิ่มขึ้นในมนุษย์พบได้ใน:
- การบาดเจ็บที่น้ำลาย (รวมถึงการใส่ท่อช่วยหายใจ)
- คางทูม – เนื่องจากการอักเสบของต่อมน้ำลาย
- ตับอ่อนอักเสบ – เนื่องจากความเสียหายต่อเซลล์ที่ผลิตอะไมเลส
- ไตวาย – เนื่องจากการขับถ่ายลดลง
การอ่านค่าอะไมเลสทั้งหมดมากกว่า 10 เท่าของขีด จำกัด บนของค่าปกติ (ULN) เป็นการชี้นำของตับอ่อนอักเสบ ULN ห้าถึง 10 เท่าอาจบ่งบอกถึงโรค ileus หรือ duodenal หรือไตวายและมักพบระดับความสูงที่ต่ำกว่าในโรคต่อมน้ำลาย
ยีน
- น้ำลายไหล – AMY1A, AMY1B, AMY1C
- ตับอ่อน – AMY2A, AMY2B
ในเมล็ดข้าว
กิจกรรมของα-Amylase ในเมล็ดข้าวถูกวัดโดยตัวอย่างเช่น Hagberg – Perten Falling Number การทดสอบเพื่อประเมินความเสียหายของการแตกหน่อหรือวิธี Phadebas เกิดขึ้นในข้าวสาลี
ใช้ในอุตสาหกรรม
α-Amylase ใช้ในการผลิตเอทานอลเพื่อสลายแป้งในธัญพืชให้เป็นน้ำตาลที่หมักได้
ขั้นตอนแรกในการผลิตน้ำเชื่อมข้าวโพดฟรุกโตสสูงคือการบำบัดแป้งข้าวโพดด้วยα-amylase ซึ่งจะทำให้น้ำตาลโอลิโกแซ็กคาไรด์โซ่สั้นลง
α-amylase เรียกว่า“ Termamyl” มีที่มาจาก บาซิลลัสไลเคนนิฟอร์มนอกจากนี้ยังใช้ในผงซักฟอกบางชนิดโดยเฉพาะน้ำยาล้างจานและผงซักฟอกขจัดแป้ง
ดูอะไมเลสสำหรับการใช้งานเพิ่มเติมของตระกูลอะไมเลสโดยทั่วไป
ศักยภาพในการใช้ทางการแพทย์
α-Amylase แสดงให้เห็นถึงประสิทธิภาพในการย่อยสลายฟิล์มชีวภาพของแบคทีเรียโพลีจุลชีพโดยการไฮโดรไลซิสการเชื่อมโยงไกลโคซิดิกα (1-4) ภายในโครงสร้างเมทริกซ์เอ็กโซโพลีแซ็กคาไรด์ของสารโพลีเมอร์นอกเซลล์ (EPS)
การยับยั้งบัฟเฟอร์
มีรายงานว่าโมเลกุลของ tris สามารถยับยั้งα-amylases ของแบคทีเรียจำนวนหนึ่งได้ดังนั้นจึงไม่ควรใช้ในทริสบัฟเฟอร์
การกำหนด
มีหลายวิธีในการตรวจหากิจกรรมของα-amylase และอุตสาหกรรมต่างๆมักจะพึ่งพาวิธีการที่แตกต่างกัน การทดสอบไอโอดีนของแป้งซึ่งเป็นการพัฒนาของการทดสอบไอโอดีนขึ้นอยู่กับการเปลี่ยนสีเนื่องจากα-amylase ย่อยสลายแป้งและมักใช้ในหลาย ๆ งาน การทดสอบที่คล้ายกัน แต่ผลิตในอุตสาหกรรมคือการทดสอบ Phadebas amylase ซึ่งใช้เป็นการทดสอบเชิงคุณภาพและเชิงปริมาณในหลายอุตสาหกรรมเช่นผงซักฟอกแป้งต่างๆอาหารเม็ดและมอลต์และชีววิทยาทางนิติวิทยาศาสตร์
สถาปัตยกรรมโดเมน
α-Amylases มีโดเมนโปรตีนที่แตกต่างกันจำนวนมาก โดเมนตัวเร่งปฏิกิริยามีโครงสร้างประกอบด้วยถังอัลฟา / เบต้าแปดเกลียวที่มีไซต์ที่ใช้งานอยู่ถูกขัดจังหวะด้วยโดเมนที่จับกับแคลเซียมของกรดอะมิโน 70 ที่ยื่นออกมาระหว่างเกลียวเบต้า 3 และอัลฟาเฮลิกซ์ 3 และคาร์บอกซิลเทอร์มินัลกรีก โดเมนเบต้าบาร์เรลที่สำคัญ อัลฟา – อะไมเลสหลายตัวมีโดเมนแผ่นเบต้าซึ่งโดยปกติจะอยู่ที่ปลายทาง C โดเมนนี้ได้รับการจัดระเบียบเป็น beta-sheet antiparallel แบบห้าเส้น อัลฟา – อะไมเลสหลายตัวมีโดเมน all-beta โดยปกติจะอยู่ที่ C terminus
.













Discussion about this post